现在我基本不会因为慢病毒感染发愁了,已基本摸清楚细胞的尿性。
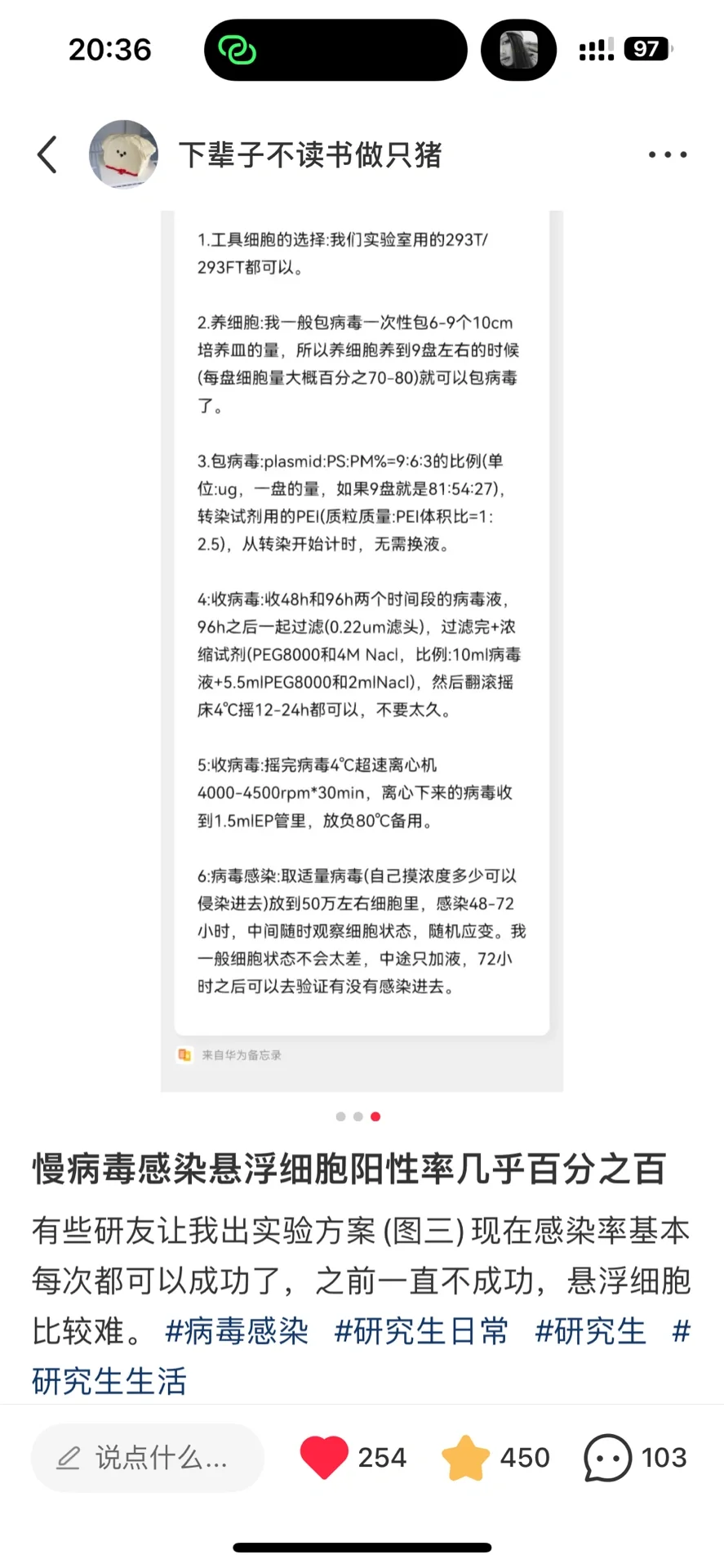
这篇笔记说的是感染完病毒完后面的流程了,前面的流程:包装病毒protocol,包装病毒和感染细胞的tips之前发过,大家自行翻看。
✅嘌呤霉素浓度的确定:
可以去查文献,如果文献查不到,那就使用这种方法,贴壁细胞和悬浮细胞一样的步骤是:摸puro浓度的过程,用药设置浓度梯度处理细胞,处理1天或两天分别观察细胞状态和死亡情况,选择细胞死亡率在百分之50的那个临界浓度上下浮动确定用药浓度,一般悬浮细胞比较敏感用药浓度比较低,几百ng,贴壁细胞用药浓度高,可以达到ug级别。
✅筛选阳性细胞and构建稳株的前提:
病毒感染阳性率至少大于百分之30,阳性率太低不行,容易失败。(关于如何提高病毒感染效率看合集~细胞实验~里的笔记)
✅如何筛选阳性细胞
确定好浓度以后,加对应浓度的药物进入已感染的细胞里。
💅重点来了~悬浮细胞筛一天,停一天,停一天以后继续筛,再停,这样筛2~3次,具体几次看情况,根据细胞状态自己感受。
贴壁细胞筛两天,停一天,再继续筛,如果特别敏感的贴壁细胞用和悬浮一样的方法。
停药方法:筛一天以后离心,离心转速:400rpm*5min,悬浮细胞离一次,贴壁细胞离两次,离完以后PBS洗一遍,然后放到新的培养基里,就算停止puro筛选。
小贴士:
1.悬浮细胞洗一遍就行,贴壁起码洗2~3遍,贴壁细胞阴性细胞和阳性细胞容易粘住,多洗两遍。
2.去掉死细胞也就是阴性细胞,只保留阳性细胞,这个筛选的过程,离心速度一定不要高!!!400~500rpm即可,不然筛不掉的。